Explicación de la Ley de las Presiones Parciales de Dalton

La Ley de las Presiones Parciales de Dalton es un concepto fundamental en la química y la fisicoquímica, que explica la relación entre la presión total de un gas y las presiones parciales de sus componentes. Esta ley, establecida por el químico inglés John Dalton en el siglo XIX, señala que la presión total de un gas es la suma de las presiones parciales de cada uno de sus componentes. Esta ley es crucial para entender la interacción entre gases y su comportamiento en diferentes condiciones, y ha tenido un impacto significativo en la comprensión de la termodinámica y la química atmosférica.
- Explicación de la Ley de las Presiones Parciales de Dalton
- ¿Qué es la ley de Dalton y que describir?
- ¿Qué es la ley de Dalton y qué describe?
- ¿Qué es la ley de presiones parciales de Dalton cómo se aplica en los procesos de destilación?
- ¿Cómo se hace la ley de Dalton?
- ¿Que entiende por presiones parciales?
- ¿Qué entiende por presiones parciales?
- Mas informacion
Explicación de la Ley de las Presiones Parciales de Dalton
La ley de las presiones parciales de Dalton, propuesta por el químico inglés John Dalton en 1801, establece que la presión total de un gas es la suma de las presiones parciales de cada uno de los gases que lo componen. Esta ley se basa en la hipótesis de que cada gas en una mezcla de gases se comporta como si fuera el único presente en el espacio ocupado por la mezcla. A continuación, se presentan los subtítulos H3 y la tabla con más detalles sobre esta ley.
Definición de Presión Parcial
La presión parcial de un gas en una mezcla es la presión que ejercería ese gas si ocupara todo el volumen de la mezcla. La presión parcial se puede calcular utilizando la fórmula: Presión parcial = (Fracción molar del gas) (Presión total) Donde la fracción molar es la relación entre el número de moles del gas y la suma del número de moles de todos los gases en la mezcla.
Aplicación de la Ley de Dalton
La ley de Dalton se aplica en situaciones en las que se necesita calcular la presión total de una mezcla de gases o la presión parcial de uno de ellos. Por ejemplo, si se tiene una mezcla de gases compuesta por 2 moles de oxígeno (O2) y 3 moles de nitrógeno (N2) a una presión total de 5 atmósferas, se puede calcular la presión parcial de cada gas utilizando la ley de Dalton.
Explorando las Obras Más Importantes de Marcel DuchampEjemplos de Aplicación
Un ejemplo común de aplicación de la ley de Dalton es la composición del aire atmosférico. El aire está compuesto por un 21% de oxígeno (O2), un 78% de nitrógeno (N2) y un 1% de gases nobles. Si se conoce la presión atmosférica total, se puede calcular la presión parcial de cada gas utilizando la ley de Dalton.
Limitaciones de la Ley de Dalton
Aunque la ley de Dalton es una herramienta útil para calcular las presiones parciales de gases en una mezcla, no se aplica a todas las situaciones. En particular, no se cumple en situaciones en las que los gases interaccionan entre sí, como en el caso de los gases reactivos o a altas presiones.
Importancia en la Química y la Física
La ley de Dalton es fundamental en la química y la física, ya que permite calcular las presiones parciales de gases en mezclas y entender mejor la composición de gases. Esta ley ha sido utilizada en numerosas aplicaciones, desde la investigación en laboratorio hasta la comprensión de la composición del aire atmosférico.
| Gas | Fracción Molar | Presión Parcial |
|---|---|---|
| Oxígeno (O2) | 0.21 | 1.05 atm |
| Nitrógeno (N2) | 0.78 | 3.9 atm |
| Gases Nobles | 0.01 | 0.05 atm |
¿Qué es la ley de Dalton y que describir?

¿Qué es la ley de Dalton y qué describe?
La ley de Dalton, también conocida como la ley de las proporciones definidas, es una ley fundamental en la química que describe la relación entre las cantidades de los componentes de una sustancia compuesta. Fue formulada por el químico inglés John Dalton en 1803 y se basa en la idea de que la materia está compuesta por átomos indivisibles.
Definición de la ley de Dalton
La ley de Dalton establece que, en una sustancia compuesta, las cantidades relativas de los componentes están en proporciones simples y constantes. Esta ley se basa en la teoría atómica, que afirma que la materia está compuesta por átomos indivisibles. Cada átomo de un elemento es idéntico y posee una masa característica, y los átomos de un elemento no se transforman en átomos de otro elemento.
Aplicaciones de la ley de Dalton
La ley de Dalton ha tenido un gran impacto en la química y ha permitido la determinación de las fórmulas químicas de las sustancias compuestas. Algunas de las aplicaciones más importantes de esta ley son:
- Establecer la relación entre la cantidad de componentes: La ley de Dalton permite determinar la relación entre las cantidades de los componentes en una sustancia compuesta, lo que es fundamental para la determinación de las fórmulas químicas.
- Identificar la pureza de una sustancia: Esta ley también permite determinar si una sustancia es pura o una mezcla, ya que en las sustancias puras, la relación entre los componentes es constante.
- Establecer la base para la ley de las proporciones múltiples: La ley de Dalton también es la base para la ley de las proporciones múltiples, que describe la relación entre las cantidades de los componentes en sustancias compuestas.
Limitaciones de la ley de Dalton
Aunque la ley de Dalton ha sido fundamental para el desarrollo de la química, no es perfecta y presenta algunas limitaciones:
Intrigantes Características del Núcleo de la Tierra que Te Sorprenderán- No considera la existencia de isotopos: La ley de Dalton no considera la existencia de isotopos, que son átomos del mismo elemento con masas diferentes.
- No considera la formación de compuestos no estequiométricos: Esta ley asume que los componentes de una sustancia compuesta se combinan en proporciones simples y constantes, lo que no siempre es cierto.
- No explica la formación de soluciones: La ley de Dalton no describe la formación de soluciones, en las que las cantidades de los componentes no están en proporciones simples y constantes.
¿Qué es la ley de presiones parciales de Dalton cómo se aplica en los procesos de destilación?
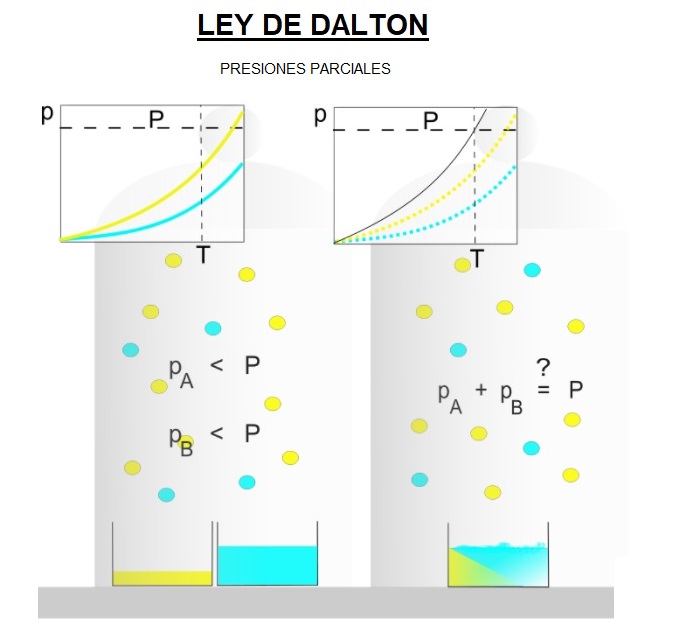
¿Qué es la ley de presiones parciales de Dalton?
La ley de presiones parciales de Dalton, nombrada en honor al químico inglés John Dalton, establece que la presión total de un gas en una mezcla es igual a la suma de las presiones parciales de cada uno de los gases que la componen. Esta ley se aplica en situaciones en las que se encuentran mezcladas varias sustancias gaseosas, como en la destilación, y es fundamental para entender la separación de componentes en una mezcla.
¿Cómo se aplica en los procesos de destilación?
En los procesos de destilación, la ley de Dalton se aplica de la siguiente manera: si se calienta una mezcla de líquidos con puntos de ebullición diferentes, los vapores de cada componente se producirán en cantidades proporcionales a sus presiones parciales. A medida que se va evaporando cada componente, su presión parcial aumenta, lo que hace que su temperatura de ebullición disminuya. De esta forma, se puede separar cada componente de la mezcla a través de la condensación de sus vapores a temperaturas específicas.
Importancia en la separación de componentes
La aplicación de la ley de Dalton en la destilación es crucial para la separación de componentes en una mezcla. Esta ley permite predecir la cantidad de cada componente que se evaporará en función de sus propiedades termodinámicas y la presión total del sistema. A través de la regulación de la temperatura y la presión, se puede controlar la evaporación selectiva de cada componente, lo que hace que la destilación sea un método efectivo para la separación y purificación de sustancias.
Jeroglíficos Egipcios: Significado y Cómo Leerlos- Separación de componentes: La ley de Dalton permite separar los componentes de una mezcla basándose en sus presiones parciales y temperaturas de ebullición.
- Control de la evaporación: Al regular la temperatura y la presión, se puede controlar la evaporación selectiva de cada componente.
- Efectividad en la purificación: La destilación, con la aplicación de la ley de Dalton, es un método efectivo para la separación y purificación de sustancias.
¿Cómo se hace la ley de Dalton?
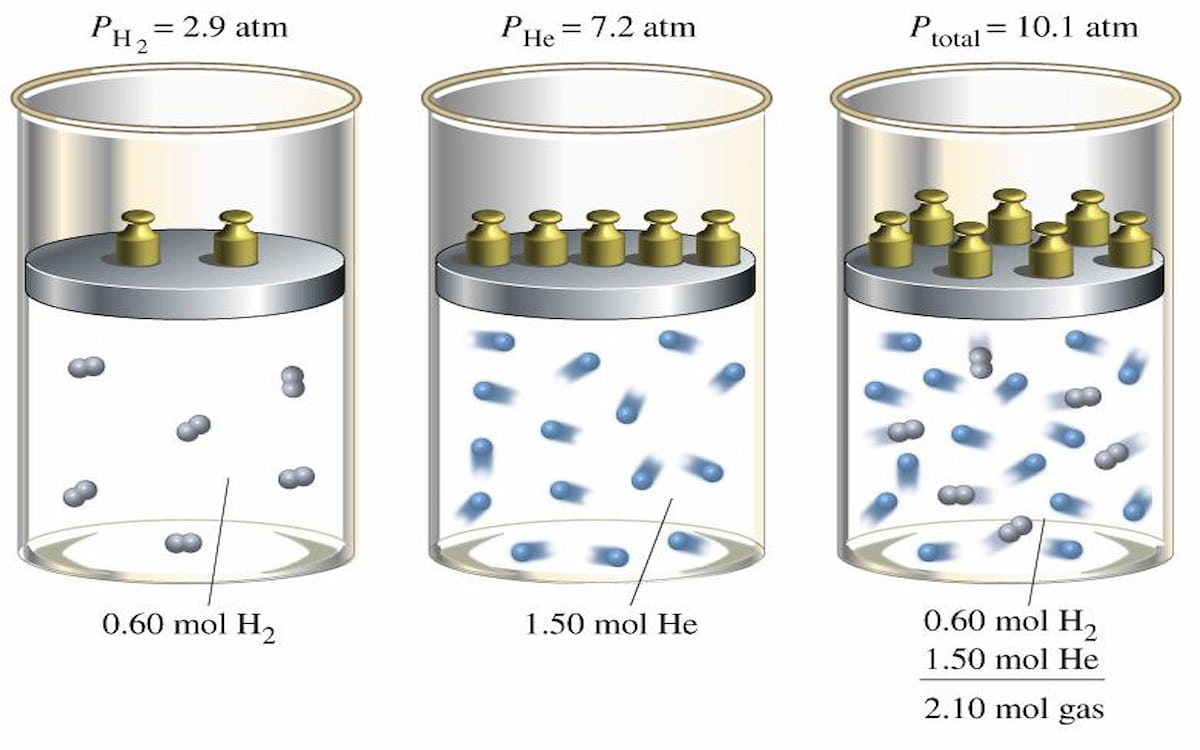
La ley de Dalton, también conocida como la ley de las proporciones recíprocas, es una teoría química propuesta por John Dalton en 1803. Esta ley establece que, en una sustancia química pura, los átomos de un elemento están presentes en cantidades proporcionales y constantes. Esta teoría se basa en la idea de que los átomos son indivisibles y que la materia está compuesta por partículas discretas. A continuación, se presentan los pasos para hacer la ley de Dalton:
1. Identificar los componentes
Para aplicar la ley de Dalton, es necesario identificar los componentes de la sustancia química. En primer lugar, se deben determinar los elementos que componen la sustancia. Luego, se necesitan las cantidades de cada elemento presentes en la sustancia.
- Identificar los elementos: La sustancia química está compuesta por átomos de uno o más elementos.
- Determinar cantidades: Se necesitan las cantidades de cada elemento presentes en la sustancia, generalmente expresadas en gramos o moles.
2. Calcular la proporción
Una vez que se han identificado los componentes y se han determinado sus cantidades, se puede calcular la proporción entre ellos. Esta proporción es constante y caracteriza la sustancia química.
La Balsa de la Medusa: Comentario y Análisis Detallado- Dividir cantidades: Dividir la cantidad de cada elemento entre la cantidad del otro elemento.
- Reducir a la menor proporción: Reducir la proporción a la menor relación posible entre los dos números.
3. Aplicar la ley
Finalmente, se aplica la ley de Dalton para determinar la fórmula química de la sustancia. La ley establece que, en una sustancia química pura, los átomos de un elemento están presentes en cantidades proporcionales y constantes.
- Asignar subíndices: Asignar subíndices a los elementos en la fórmula química para representar sus cantidades relativas.
- Verificar la proporción: Verificar que la proporción entre los subíndices sea la misma que la proporción calculada anteriormente.
¿Que entiende por presiones parciales?

¿Qué entiende por presiones parciales?
Las presiones parciales se refieren a la contribución individual de cada gas en una mezcla gaseosa a la presión total. Esta concepto es fundamental en la química y la física, ya que permite entender la interacción entre gases en un medio compartido y cómo cada uno de ellos aporta a la presión total del sistema.
Presión parcial y ley de Dalton
La ley de Dalton establece que la presión total de una mezcla gaseosa es igual a la suma de las presiones parciales de cada uno de los gases que la componen. Esta ley se expresa matemáticamente como:
- PT = PP1 + PP2 + ... + PPn
- Donde PT es la presión total del sistema.
- PP1, PP2, ..., PPn son las presiones parciales de cada uno de los gases presentes en la mezcla.
Calculo de la presión parcial
Para calcular la presión parcial de un gas en una mezcla, se puede utilizar la fórmula:
- PP = PT X
- Donde PP es la presión parcial del gas.
- PT es la presión total del sistema.
- X es la fracción molar del gas en la mezcla.
Importancia de las presiones parciales
Las presiones parciales son fundamentales en la comprensión de procesos como la respiración, la fermentación y la reacción química. En la respiración, por ejemplo, la presión parcial del oxígeno en el aire es la que permite que este se disuelva en la sangre y se transporte a las células del cuerpo. En la fermentación, la presión parcial del dióxido de carbono es responsable de la formación de burbujas en alimentos y bebidas.
Mas informacion
¿Qué es la ley de las presiones parciales de Dalton?
La ley de las presiones parciales de Dalton, establecida por John Dalton en 1801, es una de las leyes más importantes en la química y la fisicoquímica. Esta ley establece que la presión total de un gas es la suma de las presiones parciales de cada uno de los gases presentes en la mezcla. En otras palabras, la presión total de un gas es la suma de las presiones que cada gas ejercería si fuera el único presente en el volumen. Esta ley es fundamental para entender la comportamiento de las mezclas gaseosas y es utilizada en una amplia variedad de campos, como la química, la física, la biología y la medicina.
¿Cómo se calcula la presión parcial de un gas?
La presión parcial de un gas se calcula utilizando la fórmula de Dalton: Ptotal = P1 + P2 + ... + Pn, donde Ptotal es la presión total de la mezcla gaseosa y P1, P2, ..., Pn son las presiones parciales de cada uno de los gases presentes en la mezcla. Para calcular la presión parcial de un gas en particular, se utiliza la fórmula: Pparcial = (Ptotal Xgas), donde Xgas es la fracción molar del gas en la mezcla. Esta fórmula es fundamental para determinar la contribución de cada gas a la presión total de la mezcla.
¿Qué son las fracciones molares?
Las fracciones molares, también conocidas como fracciones molares de Dalton, son una medida utilizada para expresar la composición de una mezcla gaseosa. Se definen como la relación entre el número de moles de un gas y el número total de moles de todos los gases presentes en la mezcla. Las fracciones molares se representan con la letra X seguida del símbolo del gas, por ejemplo, XO2 para el oxígeno. Esta medida es fundamental para aplicar la ley de las presiones parciales de Dalton, ya que permite calcular la presión parcial de cada gas en la mezcla.
¿Cómo se aplica la ley de las presiones parciales de Dalton en la respiración humana?
La ley de las presiones parciales de Dalton se aplica directamente en la respiración humana, ya que el aire que respiramos es una mezcla de gases, principalmente oxígeno (O2), nitrógeno (N2) y dióxido de carbono (CO2). La presión parcial del oxígeno en el aire es la responsable de que este se disuelva en la sangre y se transporte a través del cuerpo. La presión parcial del dióxido de carbono, por su parte, es la responsable de que este se elimine del cuerpo a través de la respiración. La aplicación de la ley de las presiones parciales de Dalton en la respiración humana es crucial para entender cómo se regulan estas funciones vitales.
Si quieres conocer otros artículos parecidos a Explicación de la Ley de las Presiones Parciales de Dalton puedes visitar la categoría Literatura y Filosofía.

Entradas relacionadas