Hidróxidos: Una Guía Práctica sobre su Nomenclatura
Los hidróxidos son compuestos químicos que contienen el ion hidróxido (OH-), formado por un átomo de oxígeno y uno de hidrógeno. Estos compuestos químicos son fundamentalmente bases, que se utilizan en una amplia variedad de aplicaciones, desde la fabricación de jabones y detergentes hasta la producción de alimentos y medicamentos. La nomenclatura de los hidróxidos es crucial para la identificación y clasificación de estas sustancias, y su comprensión es esencial para los profesionales de la química y la ciencia. Esta guía práctica ofrece una visión general completa de la nomenclatura de los hidróxidos, ayudando a los lectores a entender y utilizar estas sustancias con mayor eficacia.

Nomenclatura de los Hidróxidos
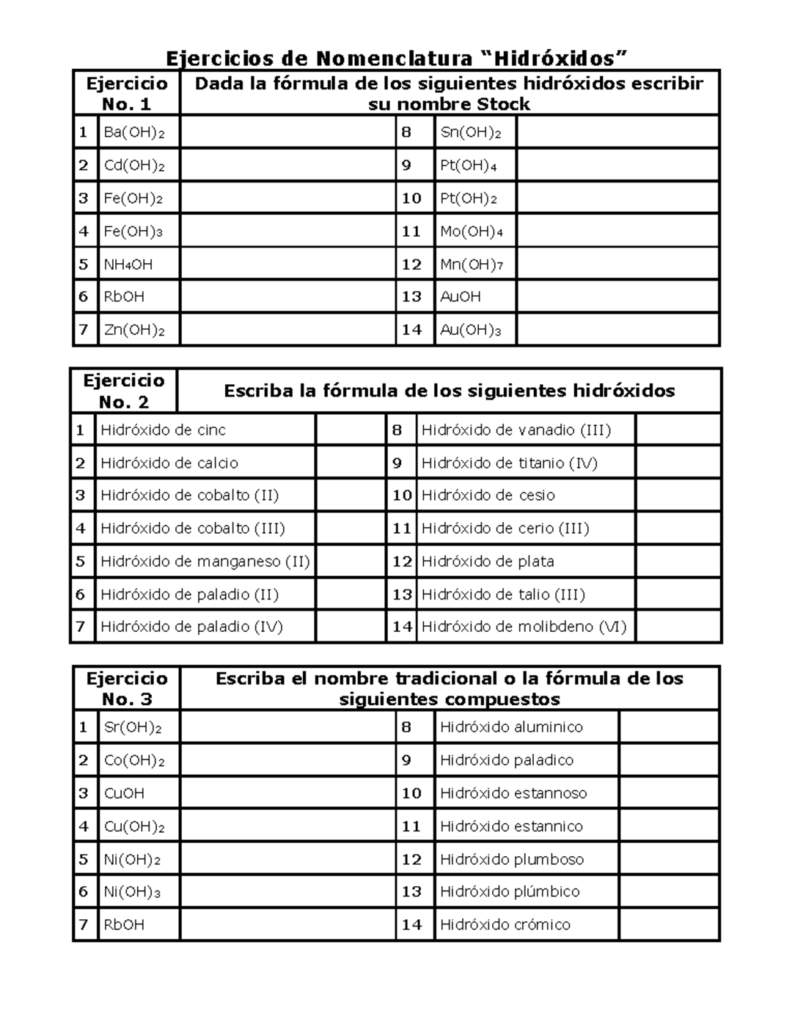
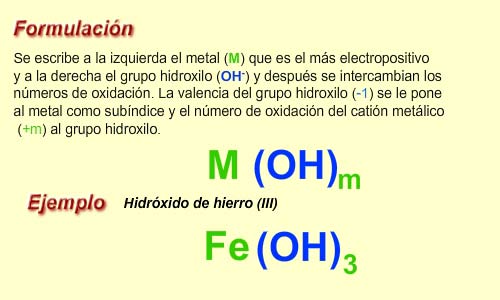
La nomenclatura de los hidróxidos se basa en la unión de un ion hidróxido (OH-) con un catión. A continuación, se presentan los pasos para nombrar un hidróxido: 1. Primero, se identifica el catión presente en la molécula. Por lo general, los cationes provienen de metales alcalinos o alcalinotérreos. 2. Luego, se agrega la palabra hidróxido al nombre del catión. Si el catión termina en -io, se cambia por -hídrico y se agrega hidróxido. 3. Si el compuesto es un hidróxido doble, se indica el nombre del primer catión seguido del nombre del segundo catión y hidróxido. 4. En el caso de los hidróxidos complejos, se indica el nombre del catión seguido del nombre del anión y hidróxido.
Tipos de Hidróxidos
Los hidróxidos se clasifican en dos categorías principales: hidróxidos alcalinos y hidróxidos alcalinotérreos.
Hidróxidos Alcalinos
Los hidróxidos alcalinos son aquellos que se forman a partir de los cationes de los metales alcalinos (sodio, potasio, rubidio, cesio y francio). Estos hidróxidos son bases fuertes y altamente solubles en agua.
Immanuel Kant y su Teoría del ConocimientoHidróxidos Alcalinotérreos
Los hidróxidos alcalinotérreos se forman a partir de los cationes de los metales alcalinotérreos (magnesio, calcio, estroncio, bario y radio). Estos hidróxidos son bases débiles y su solubilidad en agua varía.
Propiedades de los Hidróxidos
Los hidróxidos poseen propiedades características que dependen del tipo de catión presente en la molécula. Algunas de estas propiedades son: - Solubilidad en agua: Los hidróxidos alcalinos son altamente solubles en agua, mientras que los hidróxidos alcalinotérreos presentan una solubilidad variable. - Basicidad: Los hidróxidos alcalinos son bases fuertes, mientras que los hidróxidos alcalinotérreos son bases débiles. - Reactividad: Los hidróxidos reaccionan con ácidos para formar sales y agua.
Aplicaciones de los Hidróxidos
Los hidróxidos tienen varias aplicaciones prácticas en diferentes campos: - Industria química: Se utilizan como base en la producción de jabones, detergentes y productos de limpieza. - Medicina: Algunos hidróxidos se utilizan como antiácidos o laxantes. - Construcción: El hidróxido de calcio se utiliza en la fabricación de cemento.
En resumen, la nomenclatura de los hidróxidos depende del tipo de catión presente en la molécula. Los hidróxidos alcalinos y alcalinotérreos presentan características y aplicaciones prácticas diferentes.
Impresionantes Montañas Más Altas del Mundo que Asombran¿Qué son los hidróxidos y cuál es su nomenclatura?
Los hidróxidos son compuestos químicos que contienen el ion hidróxido (OH-). Estos compuestos se forman a través de la reacción de un metal con agua o alcalis. Los hidróxidos son bases, lo que significa que aumentan la concentración de iones hidróxido en una solución.
Clasificación de los hidróxidos
Los hidróxidos se clasifican en dos categorías principales: hidróxidos alcalinos y hidróxidos alcalinotérreos.
- Hidróxidos alcalinos: Estos son compuestos formados por un metal alcalino y el ion hidróxido. Los metales alcalinos son aquellos que se encuentran en el Grupo 1 de la tabla periódica, excepto el hidrógeno. Algunos ejemplos de hidróxidos alcalinos son NaOH (hidróxido de sodio), KOH (hidróxido de potasio) y LiOH (hidróxido de litio).
- Hidróxidos alcalinotérreos: Estos son compuestos formados por un metal alcalinotérreo y el ion hidróxido. Los metales alcalinotérreos se encuentran en el Grupo 2 de la tabla periódica. Algunos ejemplos de hidróxidos alcalinotérreos son Ca(OH)2 (hidróxido de calcio), Mg(OH)2 (hidróxido de magnesio) y Ba(OH)2 (hidróxido de bario).
Nomenclatura de los hidróxidos
La nomenclatura de los hidróxidos sigue las reglas generales de la nomenclatura química. El nombre del hidróxido se forma a través de la unión del nombre del metal y la palabra hidróxido.
Infijos: Cómo Reconocer e Identificar- Monohidróxidos: Estos son hidróxidos que contienen un solo ion hidróxido. El nombre del metal se combina con la palabra hidróxido. Ejemplos: NaOH (hidróxido de sodio), KOH (hidróxido de potasio).
- Polihidróxidos: Estos son hidróxidos que contienen más de un ion hidróxido. El nombre del metal se combina con la palabra hidróxido y se indica el número de iones hidróxido con un prefijo. Ejemplos: Ca(OH)2 (hidróxido de calcio), Mg(OH)2 (hidróxido de magnesio).
¿Cómo se identifican los hidróxidos?

Identificación de Hidróxidos
Los hidróxidos son compuestos químicos que contienen un ion hidróxido (OH-). La identificación de estos compuestos se basa en sus propiedades químicas y reacciones características. A continuación, se presentan algunas formas de identificar hidróxidos:
- Reacción con Ácidos: Los hidróxidos reaccionan con los ácidos para formar agua y sal. Esta reacción es una forma común de identificar la presencia de un hidróxido.
- Reacción con Metales: Los hidróxidos reaccionan con los metales para liberar hidrógeno gaseoso. Esta reacción indica la presencia de un hidróxido.
- Test de Litmus: El papel de litmus es un indicador químico que cambia de color en presencia de un hidróxido. El cambio de color del papel de litmus de rojo a azul indica la presencia de un hidróxido.
Características Físicas
Los hidróxidos presentan características físicas características que los ayudan a identificar:
- Apariencia: La mayoría de los hidróxidos son sólidos blancos o incoloros.
- Solubilidad: Los hidróxidos son generalmente solubles en agua, lo que facilita su identificación.
- Densidad: La densidad de los hidróxidos varía, pero la mayoría son más densos que el agua.
Uso de Instrumentos
Para identificar hidróxidos, también se utilizan instrumentos especializados:
Infinitivo en Acción: Oraciones con Verbos y Ejemplos Ilustrativos- Espectroscopia: La espectroscopia infrarroja (IR) y la resonancia magnética nuclear (RMN) permiten analizar la composición química de un compuesto, incluyendo la identificación de hidróxidos.
- Microscopio: El microscopio electrónico permite visualizar la estructura cristalina de un compuesto, lo que puede ayudar a identificar la presencia de un hidróxido.
- Titulación: La titulación es una técnica química que implica la adición de un reactivo a una muestra para determinar la cantidad de un compuesto presente. Se puede utilizar para identificar y cuantificar hidróxidos.
¿Qué son los hidróxidos PDF?

Los hidróxidos PDF son un tipo de compuestos químicos que contienen el grupo hidróxido (OH) como parte de su estructura molecular. Estos compuestos suelen ser bases débiles y son ampliamente utilizados en la industria química, la farmacología y la biología. Los hidróxidos PDF se utilizan en la fabricación de jabones, detergentes, pinturas, plásticos, medicamentos y alimentos, entre otros.
Características
Los hidróxidos PDF tienen varias características importantes:
- Solubilidad en agua: Los hidróxidos PDF son solubles en agua, lo que hace que sean fácilmente transportables y reactivos.
- Reactividad: Los hidróxidos PDF son bases débiles, lo que significa que reaccionan con ácidos débiles para formar sales y agua.
- Estabilidad: Los hidróxidos PDF suelen ser estables a temperatura ambiente y no reaccionan fácilmente con el oxígeno.
Aplicaciones
Los hidróxidos PDF tienen una amplia variedad de aplicaciones:
Interesante Resumen de Poseidón y Medusa para Conocer- Industria química: Se utilizan en la fabricación de jabones, detergentes, pinturas, plásticos y aditivos alimentarios.
- Farmacología: Se utilizan como excipientes en la fabricación de medicamentos y como componentes activos en la creación de fármacos.
- Biología: Se utilizan en la investigación y en técnicas de laboratorio, como la purificación de proteínas y la extracción de ADN.
Ventajas y desventajas
Los hidróxidos PDF presentan algunas ventajas y desventajas:
- Ventajas: Son económicos, fácilmente disponibles y no tóxicos.
- Desventajas: Pueden ser corrosivos y dañinos para la piel y los ojos.
¿Cuáles son las características de los hidróxidos?

Definición de hidróxidos
Los hidróxidos son compuestos químicos formados por un ion hidróxido (OH-) y un catión, generalmente un metal o un amoníaco. El ion hidróxido es un ion poliatómico formado por un átomo de oxígeno y un átomo de hidrógeno.
Propiedades químicas de los hidróxidos
Los hidróxidos presentan características químicas variadas dependiendo del catión con el que se combinen. Algunas de estas propiedades son:
- Alcalinidad: Los hidróxidos son bases fuertes, lo que significa que pueden aceptar fácilmente un par de electrones para formar un enlace covalente.
- Solubilidad: La solubilidad de los hidróxidos en agua varía ampliamente. Algunos hidróxidos, como el hidróxido de sodio, son muy solubles en agua, mientras que otros, como el hidróxido de calcio, son prácticamente insolubles.
- Reactividad: Los hidróxidos reaccionan con los ácidos para formar sal y agua. Esta reacción es fundamental en la formación de sales.
Uso y aplicaciones de los hidróxidos
Los hidróxidos tienen una amplia variedad de usos y aplicaciones en diferentes campos:
- Producción de jabones y detergentes: El hidróxido de sodio es ampliamente utilizado en la fabricación de jabones y detergentes, ya que reacciona con los ácidos grasos para formar jabones.
- Producción de vidrio: El hidróxido de sodio se utiliza como fundente en la fabricación de vidrio, reduciendo la temperatura necesaria para fundir el silicato.
- Tratamiento de aguas: Los hidróxidos se utilizan en el tratamiento de aguas para neutralizar la acidez y ajustar el pH.
Mas informacion
¿Qué son los hidróxidos?
Los hidróxidos son compuestos químicos formados por la unión de un metal con un grupo hidroxilo (OH). Estos compuestos se utilizan en una amplia variedad de aplicaciones, desde la fabricación de jabones y detergentes hasta la elaboración de cementos y hormigones. La nomenclatura de los hidróxidos se basa en la identificación del metal y la cantidad de grupos hidroxilo presentes en la molécula. Los hidróxidos son importantes en la química inorgánica y se utilizan en la formación de sales, ácidos y bases.
¿Cómo se nombra a los hidróxidos?
La nomenclatura de los hidróxidos se basa en el nombre del metal que se combina con el grupo hidroxilo. El nombre del metal se escribe como nombre normal, seguido del sufijo -hídrico o -hídride. Si el metal forma más de un hidróxido, se indica la cantidad de grupos hidroxilo presentes en la molécula con un prefijo numérico (mono, di, tri, tetra, etc.). Por ejemplo, el hidróxido de sodio (NaOH) se llama hidróxido de sodio, mientras que el hidróxido de calcio (Ca(OH)2) se llama hidróxido de calcio.
¿Cuáles son las características principales de los hidróxidos?
Los hidróxidos presentan características químicas y físicas que dependen del metal que los forma. En general, los hidróxidos son bases, es decir, aceptan protones (iones hidrógeno) y liberan iones hidroxilo (OH-). Esta propiedad hace que los hidróxidos sean útiles en la elaboración de jabones y detergentes, ya que permiten la formación de espuma y la remoción de suciedad. Los hidróxidos también pueden ser utilizados como catalizadores en reacciones químicas y como agentes de neutralización en la elaboración de cementos y hormigones.
¿Qué son los hidróxidos más comunes?
Entre los hidróxidos más comunes se encuentran el hidróxido de sodio (NaOH), el hidróxido de calcio (Ca(OH)2), el hidróxido de magnesio (Mg(OH)2) y el hidróxido de aluminio (Al(OH)3). El hidróxido de sodio es ampliamente utilizado en la industria química y en la elaboración de jabones y detergentes. El hidróxido de calcio es fundamental en la construcción y se utiliza en la elaboración de cementos y hormigones. El hidróxido de magnesio se utiliza como antiácido en la medicina y el hidróxido de aluminio se emplea en la fabricación de aluminio y como coagulante en el tratamiento del agua.
Si quieres conocer otros artículos parecidos a Hidróxidos: Una Guía Práctica sobre su Nomenclatura puedes visitar la categoría Ciencia y Tecnología.

Entradas relacionadas