La Reacción Química: Definición y Ejemplos Claros para Entender el Proceso
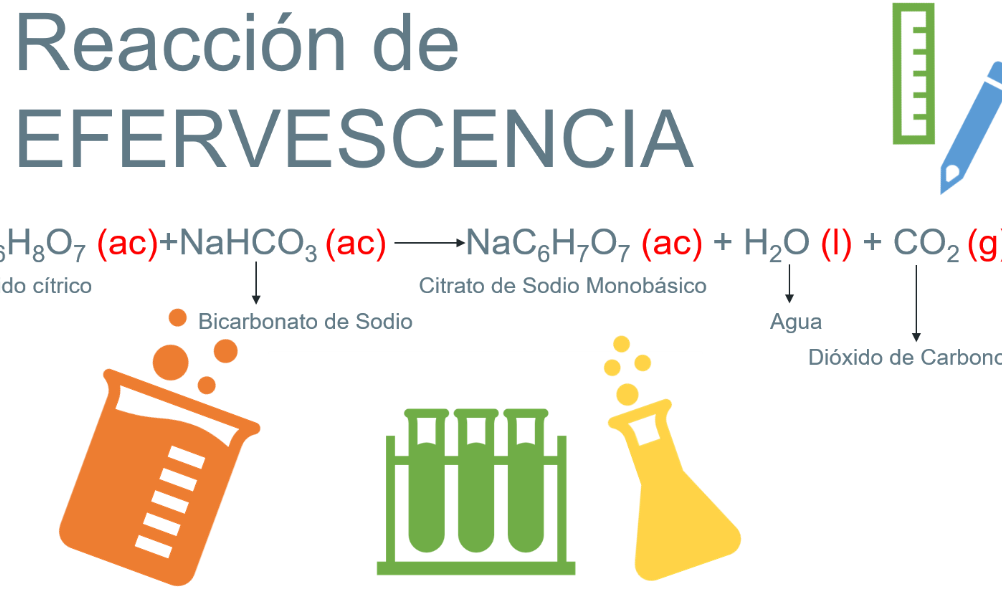
La reacción química es un proceso fundamental en la química, que implica la transformación de sustancias químicas, denominadas reactivos, en nuevas sustancias, llamadas productos. Esta transformación se produce a través de la formación o ruptura de enlaces químicos, liberando o absorbiendo energía en forma de calor. Las reacciones químicas son la base de la mayoría de los procesos naturales y tecnológicos, y su comprensión es esencial para entender la forma en que se producen y se utilizan las sustancias químicas en la vida cotidiana y en la industria.

Definición y Ejemplos Claros de la Reacción Química
La reacción química es un proceso en el cual una o más sustancias, llamadas reactantes, se transforman en una o más nuevas sustancias, denominadas productos. Esta transformación se produce a través de la formación o ruptura de enlaces químicos entre los átomos de los reactantes. Las reacciones químicas suelen estar acompañadas por cambios en la energía y la masa de los participantes.
Tipos de Reacciones Químicas
Las reacciones químicas se clasifican en varias categorías, dependiendo de la naturaleza de la reacción y los tipos de sustancias involucradas. Algunos de los principales tipos de reacciones químicas son: - Síntesis: En estas reacciones, dos o más sustancias se unen para formar una nueva sustancia. Un ejemplo clásico es la formación de agua (O) a partir de hidrógeno () y oxígeno (O2). - Descomposición: En estas reacciones, una sustancia se rompe en dos o más sustancias más simples. Un ejemplo es la descomposición del agua en hidrógeno y oxígeno. - Reacción de Sustitución: En estas reacciones, un átomo o grupo de átomos en una sustancia es reemplazado por otro átomo o grupo de átomos. Un ejemplo es la reacción entre el cloruro de sodio (NaCl) y la plata nitrato (AgNO3), que produce cloruro de plata (AgCl) y nitrato de sodio (NaNO3). - Oxidación-Reducción: En estas reacciones, una sustancia gana electrones (se reduce) mientras que otra sustancia pierde electrones (se oxida). Un ejemplo es la reacción entre el sodio (Na) y el cloro (Cl2), que produce cloruro de sodio (NaCl).
Factores que Afectan la Velocidad de las Reacciones Químicas
La velocidad de las reacciones químicas depende de varios factores, como la temperatura, la concentración de los reactantes, la superficie de contacto entre los reactantes y la presencia de catalizadores. - Temperatura: A medida que aumenta la temperatura, la energía cinética de las partículas aumenta, lo que hace que estas colisionen con más frecuencia y aumenten las posibilidades de que se produzcan reacciones químicas. - Concentración: A medida que aumenta la concentración de los reactantes, aumenta la probabilidad de que estas partículas se encuentren y reaccionen entre sí. - Superficie de Contacto: Cuanto mayor sea la superficie de contacto entre los reactantes, más rápido se producirá la reacción química. - Catalizadores: Los catalizadores son sustancias que aceleran la velocidad de las reacciones químicas sin ser consumidas durante el proceso. Un ejemplo es la enzima lactasa, que ayuda a descomponer la lactosa en glucosa y galactosa.
La Teoría de la Personalidad según Freud: Lo EsencialReacciones Químicas en la Vida Diaria
Las reacciones químicas están presentes en todos los aspectos de la vida diaria. Algunos ejemplos incluyen: - Respiración Celular: La respiración celular es un proceso químico en el cual las células convierten el oxígeno y los nutrientes en dióxido de carbono y agua, liberando energía en el proceso. - Cocina: Muchas reacciones químicas ocurren durante la cocina, como la caramelización del azúcar o la coagulación de las proteínas al calentar la leche. - Producción de Energía: Las reacciones químicas se utilizan para producir energía en centrales eléctricas, como la combustión del carbón o el gas natural para producir electricidad.
Reacciones Químicas en la Naturaleza
Las reacciones químicas también ocurren naturalmente en el medio ambiente. Algunos ejemplos incluyen: - Photosíntesis: Las plantas utilizan la energía solar para convertir el dióxido de carbono y el agua en glucosa y oxígeno. - Descomposición: La descomposición de la materia orgánica es un proceso químico natural en el cual la materia se descompone en sus componentes más simples. - Weathering: El weathering es un proceso químico en el cual las rocas se descomponen debido a la acción del agua, el viento y la temperatura.
Reacciones Químicas en la Industria
Las reacciones químicas también son fundamentales en la industria, ya que se utilizan para producir una amplia variedad de productos. Algunos ejemplos incluyen: - Producción de Plásticos: Las reacciones químicas se utilizan para producir plásticos a partir de petróleo y gas natural. - Producción de Medicamentos: Las reacciones químicas se utilizan para sintetizar medicamentos y otros productos farmacéuticos. - Producción de Alimentos: Las reacciones químicas se utilizan en la elaboración de alimentos procesados, como la conservación, la texturización y la adición de sabor y color.
| Tipo de Reacción | Ejemplo |
|---|---|
| Síntesis | Formación de agua a partir de hidrógeno y oxígeno |
| Descomposición | Descomposición del agua en hidrógeno y oxígeno |
| Reacción de Sustitución | Reacción entre cloruro de sodio y plata nitrato |
| Oxidación-Reducción | Reacción entre sodio¿Qué es la reacción química y un ejemplo?
Definición de reacción químicaLa reacción química es un proceso en el que se transforma una sustancia o sustancias (reactantes) en otra u otras sustancias (productos) a través de la ruptura o formación de enlaces químicos. Las reacciones químicas suelen estar acompañadas de cambios en la energía, la temperatura y el estado de agregación de las sustancias involucradas. Ejemplo de reacción químicaUn ejemplo clásico de reacción química es la combustión del metano (CH4) en presencia de oxígeno (O2). En esta reacción, el metano y el oxígeno se convierten en dióxido de carbono (CO2) y agua (H2O). La ecuación química que describe esta reacción es: CH4 + 2O2 → CO2 + 2H2O Tipos de reacciones químicasLas reacciones químicas se clasifican en diferentes tipos, como:
¿Qué es una reacción química y qué ocurre durante este proceso?
Las reacciones químicas son procesos en los que se transforman sustancias químicas, es decir, se rompen o se forman enlaces químicos entre átomos o moléculas. Estas reacciones implican la conversión de un conjunto de sustancias, llamadas reactantes, en un nuevo conjunto de sustancias, denominadas productos. Durante este proceso, no se crean ni se destruyen átomos, solo se reorganizan para formar nuevas sustancias. Tipos de reacciones químicasExisten varias clasificaciones de reacciones químicas, dependiendo de sus características y del tipo de transformaciones que se producen. A continuación, se presentan algunos de los principales tipos:
Características de las reacciones químicasLas reacciones químicas presentan ciertas características comunes:
Factores que influyen en las reacciones químicasLas reacciones químicas se ven influenciadas por varios factores:
¿Cuáles son los 4 tipos de reacciones químicas?
IntroducciónLas reacciones químicas son procesos en los que se transforman sustancias químicas, produciendo nuevas sustancias con propiedades y características diferentes. Estas reacciones se clasifican en varios tipos, dependiendo de sus características y de los cambios químicos que se producen. En este texto, vamos a analizar los 4 tipos principales de reacciones químicas. 1. Reacciones de SíntesisLas reacciones de síntesis, también llamadas reacciones de formación, son aquellas en las que dos o más sustancias se unen para formar una nueva sustancia. Esta reacción implica la formación de enlaces químicos entre los átomos de las sustancias iniciales, lo que da lugar a la formación de una nueva sustancia con propiedades diferentes. Un ejemplo clásico es la formación de agua (O) a partir de hidrógeno () y oxígeno (O2).
2. Reacciones de DescomposiciónLas reacciones de descomposición son aquellas en las que una sustancia se rompe en dos o más sustancias. En este tipo de reacción, los enlaces químicos entre los átomos se rompen, lo que da lugar a la formación de nuevas sustancias. Un ejemplo es la descomposición del agua (O) en hidrógeno () y oxígeno (O2) en presencia de energía.
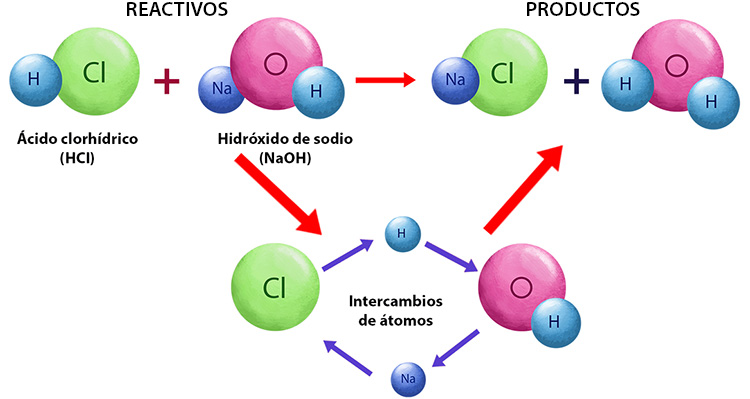
3. Reacciones de ReemplazoLas reacciones de reemplazo, también llamadas reacciones de sustitución, son aquellas en las que un átomo o un grupo de átomos en una sustancia es reemplazado por otro átomo o grupo de átomos. En este tipo de reacción, se produce un intercambio de átomos entre las sustancias iniciales, lo que da lugar a la formación de nuevas sustancias. Un ejemplo es la reacción entre sodio (Na) y cloruro de hidrógeno (HCl), que produce sodio cloruro (NaCl) y hidrógeno ().
4. Reacciones de CombustiónLas reacciones de combustión son aquellas en las que una sustancia reacciona con oxígeno (O2) para producir dióxido de carbono (CO2) y agua (O), liberando energía en forma de calor y luz. Un ejemplo es la combustión del metano (CH4) con oxígeno (O2), que produce dióxido de carbono (CO2) y agua (O).
¿Qué entiendes por una reacción química?
Definición de reacción químicaUna reacción química es un proceso en el que se transforma una sustancia o un conjunto de sustancias, denominadas reactantes, en otra sustancia o conjunto de sustancias, denominadas productos. Esta transformación se produce a través de la ruptura o formación de enlaces químicos entre los átomos de las moléculas de los reactantes, lo que conduce a la formación de nuevas moléculas. Las reacciones químicas se caracterizan por la transferencia de energía, que puede manifestarse en forma de calor, luz o cambios en la temperatura. A su vez, estas reacciones se clasifican en diferentes tipos, como reacciones de oxidación-reducción, reacciones ácido-base, reacciones de sustitución, reacciones de adición, entre otras. Tipos de reacciones químicasLas reacciones químicas se clasifican en diferentes categorías, dependiendo de los mecanismos y las características de la transformación. A continuación, se presentan algunos de los principales tipos de reacciones químicas:
Importancia de las reacciones químicasLas reacciones químicas son fundamentales en la vida cotidiana y en la naturaleza. A continuación, se presentan algunas de las principales importancias de estas reacciones:
Mas informacion¿Qué es una reacción química?La reacción química es un proceso en el que se transforman sustancias químicas, es decir, se produce un cambio en la composición de estas. Las reacciones químicas se basan en la interacción entre moléculas o átomos, y su resultado es la formación de nuevas sustancias químicas. En estas reacciones, las moléculas o átomos se unen o se separan, lo cual da lugar a la formación de nuevas sustancias. Las reacciones químicas se utilizan en la elaboración de alimentos, la fabricación de medicamentos, la creación de energía y en la transformación de la materia. ¿Cómo se clasifican las reacciones químicas?Las reacciones químicas se clasifican en diferentes tipos, dependiendo de sus características y los procesos involucrados. Algunos de los tipos más comunes son: reacciones de síntesis, en las que se unen dos o más sustancias para formar una nueva; reacciones de descomposición, en las que una sustancia se divide en dos o más componentes; reacciones de sustitución, en las que un átomo o grupo de átomos de una molécula reemplaza a otro átomo o grupo de átomos; y reacciones de combustión, que implican la reacción de una sustancia con el oxígeno, produciendo calor y luz. Esta clasificación es importante para entender mejor la variedad de procesos químicos que ocurren en la naturaleza y en la industria. ¿Cómo se representan las reacciones químicas?Las reacciones químicas se representan a través de ecuaciones químicas, que son expresiones simbólicas que describen la reacción. Estas ecuaciones se componen de los reactivos, que son las sustancias que se transforman, y los productos, que son las nuevas sustancias formadas. Las ecuaciones químicas se equilibran, es decir, el número de átomos de cada elemento es el mismo en los reactivos y en los productos. Esta representación es fundamental para la comprensión y la predicción de las reacciones químicas, y es utilizada en la investigación, la educación y la industria. ¿Qué son los catalizadores en las reacciones químicas?Los catalizadores son sustancias que aceleran o facilitan las reacciones químicas sin ser consumidos durante el proceso. Estas sustancias reducen la energía necesaria para que la reacción ocurra, lo cual hace que la reacción se produzca más rápido. Los catalizadores no cambian la dirección de la reacción, es decir, no alteran la relación entre los reactivos y los productos, sino que solo la aceleran. Los catalizadores son muy importantes en la industria química, ya que permiten que las reacciones se realicen de manera más eficiente y económica. Algunos ejemplos de catalizadores son los metales como el platino o el rodio, que se utilizan en la industria automotriz para reducir la contaminación, o las enzimas, que son proteínas que actúan como catalizadores en las reacciones químicas que ocurren en los seres vivos. Si quieres conocer otros artículos parecidos a La Reacción Química: Definición y Ejemplos Claros para Entender el Proceso puedes visitar la categoría Arte y Música. |




Entradas relacionadas