Ley de los Volúmenes Parciales de Amagat: Conceptos Clave
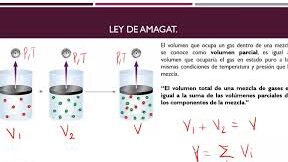
La Ley de los Volúmenes Parciales de Amagat es un concepto fundamental en la química y la fisicoquímica, que se centra en la relación entre la presión y el volumen de gases en una mezcla. Esta ley, formulada por el español José Amagat en 1880, describe cómo cada gas en una mezcla ocupa un volumen proporcional a su presión parcial. Esta ofrece una visión general de los conceptos clave detrás de esta ley, desde la presión parcial hasta la composición de las mezclas gaseosas, pasando por la relación entre la presión y el volumen de gases.

- Ley de los Volúmenes Parciales de Amagat: Conceptos Clave
- ¿Qué propone la ley de los volúmenes de combinación?
- ¿Cómo se calcula el volumen parcial?
- ¿Quién creó la ley de Amagat?
- ¿Qué es la ley de los gases?
- Mas informacion
- ¿Qué es la ley de los volúmenes parciales de Amagat?
- ¿Cómo se aplica la ley de los volúmenes parciales de Amagat?
- ¿Qué relación hay entre la ley de los volúmenes parciales de Amagat y la constante de los gases ideales?
- ¿Qué implicaciones tiene la ley de los volúmenes parciales de Amagat en la comprensión de los gases?
Ley de los Volúmenes Parciales de Amagat: Conceptos Clave
La Ley de los Volúmenes Parciales de Amagat es una herramienta fundamental en la química para entender la relación entre la cantidad de un gas y su volumen. Esta ley se basa en la idea de que el volumen de un gas es proporcional a la cantidad de sustancia del gas. A continuación, se presentan los conceptos clave de esta ley.
Definición
La Ley de los Volúmenes Parciales de Amagat establece que el volumen de un gas es directamente proporcional a la cantidad de sustancia del gas, es decir, al número de moles. Esta relación se expresa matemáticamente como V = nRT, donde V es el volumen del gas, n es el número de moles, R es la constante de los gases ideales y T es la temperatura en Kelvin.
Constante de los Gases Ideales
La constante de los gases ideales (R) es una constante fundamental en la química y la física. Su valor es de 8,3145 J/(mol·K) y se utiliza para relacionar la energía interna del gas con su temperatura y presión. Esta constante es crucial para la aplicación de la Ley de los Volúmenes Parciales de Amagat.
Leyendas: Desglosando sus Partes para Comprender su MagiaAplicaciones
La Ley de los Volúmenes Parciales de Amagat tiene varias aplicaciones prácticas en la química y la física. Por ejemplo, se utiliza para calcular la cantidad de un gas necesario para alcanzar un determinado volumen a una temperatura y presión específicas. También se aplica en la determinación de la composición de mezclas de gases, como el aire, que es una mezcla de gases con diferentes proporciones.
Limitaciones
Aunque la Ley de los Volúmenes Parciales de Amagat es una herramienta valiosa, no se aplica a todos los gases. Los gases reales no se comportan exactamente como los gases ideales, especialmente a altas presiones y bajas temperaturas. En estos casos, se utilizan ecuaciones de estado más complejas, como la ecuación de Van der Waals.
Historia
La Ley de los Volúmenes Parciales de Amagat fue formulada por el químico español Emilio Amagat en el siglo XIX. Esta ley se basa en la observación de que el volumen de un gas es proporcional a la cantidad de sustancia del gas. Esta relación se ha demostrado fundamental para la comprensión de la química y la física de los gases.
| Concepto | Definición |
|---|---|
| Ley de los Volúmenes Parciales de Amagat | Establece que el volumen de un gas es directamente proporcional a la cantidad de sustancia del gas. |
| Constante de los Gases Ideales | Es una constante fundamental en la química y la física, con un valor de 8,3145 J/(mol·K). |
| Aplicaciones | Se utiliza para calcular la cantidad de un gas necesario para alcanzar un determinado volumen y en la determinación de la composición de mezclas de gases. |
| Limitaciones | La ley no se aplica a todos los gases, especialmente a altas presiones y bajas temperaturas, donde se utilizan ecuaciones de estado más complejas. |
| Historia | Fue formulada por el químico español Emilio Amagat en el siglo XIX, basada en la observación de que el volumen de un gas es proporcional a la cantidad de sustancia del gas. |
¿Qué propone la ley de los volúmenes de combinación?

Introducción a la ley de los volúmenes de combinación
La ley de los volúmenes de combinación, también conocida como ley de Avogadro, es una ley fundamental en la química y la física que describe la relación entre la cantidad de sustancia y el volumen de un gas ideal. Esta ley propone que, a temperatura y presión constantes, el volumen de un gas ideal es directamente proporcional a la cantidad de sustancia.
Propuesta de la ley de los volúmenes de combinación
La ley de los volúmenes de combinación, propuesta por el químico italiano Amedeo Avogadro en 1811, establece que, a temperatura y presión constantes, el volumen de un gas ideal es directamente proporcional a la cantidad de sustancia. Esta ley se basa en la hipótesis de que, a igualdad de temperatura y presión, volúmenes iguales de gases contienen cantidades iguales de moléculas.
- Volúmenes iguales de gases contienen cantidades iguales de moléculas.
- A temperatura y presión constantes, el volumen de un gas ideal es directamente proporcional a la cantidad de sustancia.
- La ley de los volúmenes de combinación se basa en la hipótesis de Avogadro, que establece que, a igualdad de temperatura y presión, volúmenes iguales de gases contienen cantidades iguales de moléculas.
Aplicaciones y consecuencias de la ley de los volúmenes de combinación
La ley de los volúmenes de combinación ha tenido un gran impacto en la química y la física, ya que ha permitido establecer la relación entre la cantidad de sustancia y el volumen de un gas ideal. Algunas de las aplicaciones y consecuencias más importantes de esta ley son:
- Establecer la relación entre cantidad de sustancia y volumen: La ley de los volúmenes de combinación permite calcular la cantidad de sustancia necesaria para llenar un determinado volumen, o viceversa, lo que es fundamental en la planificación de experimentos y la determinación de cantidades necesarias de sustancias.
- Desarrollo de la teoría molecular: La ley de los volúmenes de combinación apoya la teoría molecular, que establece que la materia está compuesta por moléculas. Esta teoría ha sido fundamental para el desarrollo de la química y la física modernas.
- Establecer la constante de Avogadro: La ley de los volúmenes de combinación ha permitido la determinación de la constante de Avogadro, que es una constante fundamental en la química y la física que indica la cantidad de partículas elementales (átomos o moléculas) en un mol.
¿Cómo se calcula el volumen parcial?

El volumen parcial se calcula utilizando la fórmula:
Volumen parcial = (Presión total Volumen total) / Presión parcial
Donde:
Presión total es la suma de las presiones parciales de todos los gases en la mezcla.
Literatura Gauchesca: Resumen y Contexto HistóricoVolumen total es la suma de los volúmenes parciales de todos los gases en la mezcla.
Presión parcial es la presión que ejerce un gas en una mezcla de gases.
Tipos de presiones parciales
Existen dos tipos principales de presiones parciales:
- Presión parcial externa: Es la presión que ejerce un gas en una mezcla de gases y que se mide fuera de la mezcla.
- Presión parcial interna: Es la presión que ejerce un gas en una mezcla de gases y que se mide dentro de la mezcla.
Aplicaciones del cálculo del volumen parcial
El cálculo del volumen parcial es fundamental en varias áreas:
Los Dinosaurios: Origen y Clasificación Detallada- Química: Se utiliza para determinar la cantidad de un gas en una mezcla y, por lo tanto, para calcular la cantidad de reactivos necesarios o la cantidad de producto formado en una reacción química.
- Física: Se aplica en la resolución de problemas que involucran la expansión y compresión de gases.
- Medicina: Es importante en la respiratoria, ya que ayuda a determinar la cantidad de oxígeno y dióxido de carbono en la sangre.
¿Quién creó la ley de Amagat?

La ley de Amagat, también conocida como la ley de las mezclas ideales, fue creada por el químico español François-Marie Raoult. Esta ley describe la relación entre la presión de vapor de una mezcla y la composición de la mezcla. Esta ley se basa en la hipótesis de que la presión de vapor de cada componente de una mezcla ideal es proporcional a su fracción molar en la mezcla.
¿Qué es la ley de Amagat?
La ley de Amagat es una ley fundamental en la química y la física que describe la relación entre la presión de vapor de una mezcla y su composición. Esta ley establece que la presión de vapor de una mezcla ideal es la suma de las presiones de vapor parciales de cada uno de sus componentes, ponderadas por sus fracciones molares en la mezcla.
- Presión de vapor parcial: La presión de vapor parcial de un componente en una mezcla es la presión de vapor que tendría ese componente si fuera el único presente en la mezcla.
- Fracción molar: La fracción molar de un componente en una mezcla es la relación entre el número de moles del componente y la suma del número de moles de todos los componentes de la mezcla.
- Mezcla ideal: Una mezcla ideal es aquella en la que no hay interacción entre los componentes, es decir, no hay atracción o repulsión entre las moléculas de los componentes.
Aplicaciones de la ley de Amagat
La ley de Amagat tiene varias aplicaciones prácticas en diferentes campos:
- Química: La ley de Amagat se utiliza para determinar la presión de vapor de una mezcla, lo que es fundamental en la química para entender la estabilidad y la reactividad de las sustancias.
- Física: Esta ley se aplica en la física para entender la termodinámica de las mezclas y la relación entre la presión de vapor y la temperatura.
- Ingeniería: La ley de Amagat es utilizada en la ingeniería para diseñar y operar sistemas de separación de mezclas, como la destilación y la evaporación.
Limitaciones de la ley de Amagat
La ley de Amagat se basa en la hipótesis de que las mezclas son ideales, es decir, que no hay interacción entre los componentes. Sin embargo, en la realidad, las mezclas no siempre son ideales:
- Interacción entre componentes: En la mayoría de las mezclas, hay alguna interacción entre los componentes, lo que hace que la presión de vapor no se ajuste exactamente a la ley de Amagat.
- Concentraciones altas: A concentraciones altas, la ley de Amagat no se cumple exactamente, ya que las moléculas de los componentes están más próximas y la interacción entre ellas aumenta.
- Temperaturas extremas: La ley de Amagat se cumple mejor a temperaturas moderadas. A temperaturas extremas, la presión de vapor puede variar significativamente.
¿Qué es la ley de los gases?
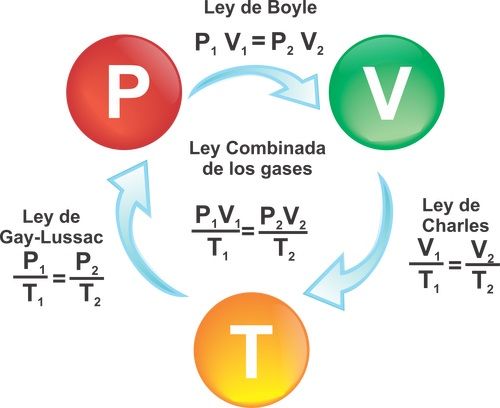
La ley de los gases, también conocida como ley de los gases ideales, es una relación matemática entre presión, volumen y temperatura de un gas ideal. Esta ley se basa en la idea de que un gas ideal se compone de partículas que no interactúan entre sí, excepto en colisiones elásticas.
Historia de la ley de los gases
La ley de los gases se desarrolló a lo largo de los siglos XVI y XVII por científicos como Galileo Galilei, Evangelista Torricelli y Blaise Pascal. Sin embargo, fue el químico inglés Robert Boyle quien enunció la ley de Boyle en 1662, que establece que, a temperatura constante, la presión y el volumen de un gas ideal son inversamente proporcionales.
- Galileo Galilei y Evangelista Torricelli realizaron experimentos sobre la presión del aire.
- Blaise Pascal demostró que la presión del aire disminuye con la altura.
- Robert Boyle enunció la ley de Boyle, que relaciona la presión y el volumen de un gas ideal.
Formulación matemática
La ley de los gases se expresa matemáticamente como:
PV = nRT
Donde:
P es la presión del gas.
V es el volumen del gas.
n es la cantidad de sustancia del gas, medida en moles.
R es la constante de los gases ideales.
T es la temperatura del gas, medida en Kelvin.
Aplicaciones prácticas
La ley de los gases tiene numerosas aplicaciones prácticas en la industria, la medicina y la investigación científica. Algunas de estas aplicaciones incluyen:
- La regulación de la presión en recipientes a presión.
- El diseño de motores de combustión interna.
- La medición de la temperatura con termómetros.
Mas informacion
¿Qué es la ley de los volúmenes parciales de Amagat?
La ley de los volúmenes parciales de Amagat es una ley fundamental en la química y la física que describe la relación entre la cantidad de un gas y su volumen. Esta ley establece que, a temperatura y presión constantes, el volumen de un gas es directamente proporcional a la cantidad de sustancia del gas. Fue descubierta por el químico español Emilio Amagat en 1880. Esta ley es fundamental para la comprensión de las propiedades de los gases y se aplica en numerosas áreas, como la química, la física, la biología y la ingeniería.
¿Cómo se aplica la ley de los volúmenes parciales de Amagat?
La ley de los volúmenes parciales de Amagat se aplica en la forma de la fórmula matemática V = nRT, donde V es el volumen del gas, n es la cantidad de sustancia del gas (medida en moles), R es la constante de los gases ideales y T es la temperatura absoluta. Esta fórmula indica que, si se conoce la cantidad de sustancia de un gas y su temperatura, se puede calcular su volumen. Esta ley es fundamental para la comprensión de las propiedades de los gases y se aplica en numerosas áreas, como la química, la física, la biología y la ingeniería, permitiendo a los científicos y técnicos determinar las cantidades y volúmenes de gases necesarios para diferentes procesos y experimentos.
¿Qué relación hay entre la ley de los volúmenes parciales de Amagat y la constante de los gases ideales?
La ley de los volúmenes parciales de Amagat y la constante de los gases ideales están estrechamente relacionadas. La constante de los gases ideales, representada por la letra R, es una constante fundamental en la química y la física que se utiliza en la fórmula V = nRT. Esta constante es la relación entre la energía cinética media de las moléculas de un gas y la temperatura absoluta. La ley de los volúmenes parciales de Amagat hace uso de esta constante para establecer la relación entre la cantidad de sustancia de un gas y su volumen. La constante de los gases ideales es una constante universal que se ha determinado experimentalmente y se utiliza en la fórmula para calcular los volúmenes de los gases.
¿Qué implicaciones tiene la ley de los volúmenes parciales de Amagat en la comprensión de los gases?
La ley de los volúmenes parciales de Amagat tiene importantes implicaciones en la comprensión de los gases. Esta ley permite a los científicos y técnicos determinar las cantidades y volúmenes de gases necesarios para diferentes procesos y experimentos. La ley también indica que, a temperatura y presión constantes, la cantidad de un gas es directamente proporcional a su volumen, lo que hace que sea fundamental para la comprensión de las propiedades de los gases y su comportamiento. La ley de los volúmenes parciales de Amagat es una herramienta esencial en la química, la física, la biología y la ingeniería, permitiendo a los profesionales de estas áreas comprender y manipular los gases de manera más efectiva.
Si quieres conocer otros artículos parecidos a Ley de los Volúmenes Parciales de Amagat: Conceptos Clave puedes visitar la categoría Ciencia y Tecnología.

Entradas relacionadas